Elektrolýza roztoku síranu měďnatého
Úloha číslo: 175
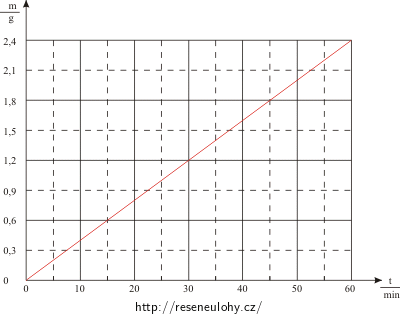
Při elektrolýze roztoku síranu měďnatého se na katodě vylučuje měď. Na obrázku je graficky znázorněná závislost hmotnosti vyloučené mědi na čase, po který elektrolýza probíhá.
Jaký je elektrický odpor roztoku v elektrolytické nádobě, jestliže napětí na elektrodách je 6 V?
Nápověda 1
K řešení použijeme Faradayovy zákony elektrolýzy.
V tabulkách si vyhledejte molární hmotnost mědi a Faradayovu konstantu.
Nápověda 2
Chemický vzorec síranu měďnatého je CuSO4.
Rozbor
Faradayovy zákony elektrolýzy říkají, že hmotnost látky vyloučené na elektrodě je přímo úměrná molární hmotnosti látky, celkovému náboji, který prošel elektrolytem, a nepřímo úměrná počtu elektronů nutných k vyloučení jedné molekuly látky. (Podrobněji najdete Faradayovy zákony v rozboru úlohy Vylučování stříbra.)
Jestliže prochází obvodem konstantní proud, je celkový náboj prošlý elektrolytem úměrný proudu a času.
Podle Ohmova zákona je proud procházející obvodem přímo úměrný napětí na elektrodách a nepřímo úměrný elektrickému odporu roztoku v nádobě.
Řešení
Podle Faradayových zákonů je hmotnost m vyloučené látky přímo úměrná molární hmotnosti látky Mm a celkovému náboji Q, který prošel elektrolytem, a nepřímo úměrná počtu elektronů ν nutných k vyloučení jedné molekuly látky
\[ m\,=\,\frac{1}{F}\,\frac{M_\mathrm{m}Q}{\nu}\,, \]kde F je Faradayova konstanta.
Prochází-li obvodem konstantní proud, je celkový prošlý náboj Q přímo úměrný proudu I a času t. Proud I je přímo úměrný napětí na elektrodách U a nepřímo úměrný elektrickému odporu elektrolytu R:
\[Q\,=\,It\,=\,\frac{U}{R}t\,.\]Hmotnost vyloučené látky můžeme tedy vyjádřit:
\[ m\,=\,\frac{1}{F}\,\frac{M_\mathrm{m}}{\nu}\,\,\frac{U}{R}t\,. \]Z této rovnice vyjádříme hledaný elektrický odpor R:
\[ R\,=\,\frac{M_\mathrm{m}Ut}{F\nu m}\,. \]Číselné dosazení
Z grafu odečteme hmotnost mědi m vyloučené při elektrolýze za daný čas t. Například za 30 minut se vyloučí 1,2 g mědi. Tedy t = 30 min, m = 1,2 g.
K vyloučení jednoho atomu mědi z roztoku CuSO4 je zapotřebí dvou elektronů, neboť měď vytváří dvoumocný kation Cu2+ (jde o síran měďnatý).
Molární hmotnost mědi Mm a Faradayovu konstantu F si najdeme v tabulkách.
Napětí na elektrodách U známe ze zadání úlohy.
t = 30 min = 1800 s zvolený čas, během kterého zkoumáme hmotnost vyloučené mědi m = 1,2 g = 1,2·10-3 kg hmotnost vyloučené mědi za čas t ν = 2 počet elektronů nutných k vyloučení jedné molekuly látky Mm = 63,5·10-3 kg mol-1 molární hmotnost látky F = 9,65·104 C mol-1 Faradayova konstanta U = 6 V napětí na elektrodách R = ? (Ω) elektrický odpor roztoku
Tyto hodnoty dosadíme do rovnice pro odpor vyjádřené v oddílu Řešení:
\[R\,=\,\frac{M_\mathrm{m}Ut}{F\nu m}\]a vypočítáme elektrický odpor roztoku v elektrolytické nádobě. Protože všechny veličiny jsou v základních jednotkách, bude konečná jednotka elektrického odporu vyjádřena v ohmech:
\[ R\,=\,\frac{63{,}5{\cdot}10^{-3}\,\cdot\,6\,\cdot\,1800}{9{,}65{\cdot}10^4\,\cdot\,2\,\cdot\,1{,}2{\cdot}10^{-3}}\,\mathrm{\Omega}\,\dot{=}\,3\,\mathrm{\Omega}\,.\]Odpověď
Elektrický odpor roztoku CuSO4 v elektrolytické nádobě je přibližně 3 Ω.
Odkaz na podobné úlohy
Další úlohy, které se zabývají Faradayovými zákony elektrolýzy, jsou úlohy Vylučování stříbra a Elektrolytický rozklad vody.






