Vylučování stříbra
Úloha číslo: 157
Jaká je hmotnost stříbra, které se během dvou hodin vyloučí proudem 1 A z roztoku dusičnanu stříbrného (AgNO3)?
Nápověda 1
Vyhledejte si Faradayovy zákony pro elektrolýzu.
Nápověda 2
Vyhledejte si v tabulkách relativní atomovou hmotnost stříbra.
Rozbor
Jev způsobený průchodem elektrického proudu kapalinou, při kterém dochází k chemickým změnám na elektrodách, se nazývá elektrolýza.
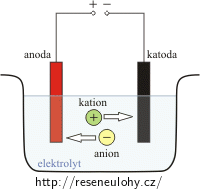
Roku 1834 anglický fyzik Michael Faraday experimentálně objevil dva zákony elektrolýzy:
1. Faradayův zákon říká, že hmotnost látky vyloučené na elektrodě je přímo úměrná celkovému náboji, který prošel elektrolytem.
Konstantu úměrnosti, která je pro danou látku charakteristická, nazýváme elektrochemický ekvivalent látky. Jeho jednotkou je kg C-1.
Tuto konstantu vypočteme díky 2. Faradayovu zákonu elektrolýzy, který zní: Elektrochemický ekvivalent látky vypočteme, jestliže molární hmotnost látky vydělíme Faradayovou konstantou a počtem elektronů nutných k vyloučení jedné molekuly.
Hodnota Faradayovy konstanty je rovna součinu elementárního náboje a Avogadrovy konstanty.
Navíc platí, že látková množství různých látek, která se vyloučí při elektrolýze týmž nábojem, jsou chemicky ekvivalentní. To znamená, že se mohou navzájem nahradit v chemické sloučenině nebo se mohou beze zbytku sloučit.
Počet elektronů, které jsou nutné k vyloučení jedné molekuly látky, poznáme podle toho, jakou mocnost má iont v dané sloučenině (tj. jaký je náboj daného iontu). V našem případě je k vyloučení jednoho atomu stříbra z roztoku AgNO3 zapotřebí 1 elektron, neboť stříbro vytváří jednomocný kationt Ag+ (jde o dusičnan stříbrný).
Molární hmotnost je hmotnost jednoho molu látky. Číselně se rovná relativní molekulové hmotnosti a její jednotkou je g mol-1.
Řešení
Podle 1. Faradayova zákona elektrolýzy je hmotnost m vyloučené látky přímo úměrná celkovému náboji Q, který prošel elektrolytem. Tedy:
\[m\,=\,AQ\,,\]kde A je elektrochemický ekvivalent látky. Jeho velikost můžeme určit pomocí 2. Faradayova zákona:
\[A\,=\,\frac{M_\mathrm{m}}{F\nu}\,,\]kde Mm je molární hmotnost látky, F značí Faradayovu konstantu (F = 9,65·104 C mol-1) a ν je počet elektronů potřebných k vyloučení jedné molekuly.
Jestliže prochází obvodem konstantní proud, je celkový prošlý náboj Q úměrný proudu I a času t:
\[Q\,=\,It\,.\]Hmotnost vyloučené látky můžeme vyjádřit jako:
\[m\,=\,\frac{M_\mathrm{m}}{F\nu}Q\,=\,\frac{M_\mathrm{m}}{F\nu}It\,.\]Nyní již můžeme dosadit číselné hodnoty a vypočítáme hmotnost vyloučeného stříbra.
\[m\,=\,\frac{108{\cdot} 10^{-3}\,\mathrm{kg\,mol^{-1}}}{1{\cdot} 9{,}65{\cdot} 10^4\,\mathrm{C\,mol^{-1}}}\cdot \hspace{5px}1\,\mathrm{A}\cdot \hspace{5px}7200\,\mathrm{s}\] \[m\,=\,8{,}06{\cdot} 10^{-3}\,\mathrm{kg}\,=\,8{,}06\,\mathrm{g}\,.\]Ar(Ag) = 108 ⇒ Mm(Ag) = 108 g mol-1 = 108·10-3 kg mol-1 ν = 1 (elektrolytem je dusičnan stříbrný) F = 9,65·104 C mol-1 I = 1 A t = 2 h = 7200 s Odpověď
Hmotnost stříbra, které se během elektrolýzy dusičnanu stříbrného vyloučí na katodě, je 8,06 g.
Odkaz na podobné úlohy
Zkuste vyřešit také úlohy Elektrolýza roztoku síranu měďnatého a Elektrolytický rozklad vody.





