Účinnost Ottova cyklu
Úloha číslo: 412
Stanovte účinnost Ottova cyklu skládajícího se z následujících 4 dějů:
- Adiabatická komprese z objemu V1 na objem V2.
- Izochorické zahřátí z teploty T2 na teplotu T3.
- Adiabatická expanze z objemu V2 zpět na objem V1.
- Izochorické ochlazení z teploty T4 zpět na počáteční teplotu T1.
Máte zadánu Poissonovu konstantu plynu κ a tzv. kompresní poměr
\[r=\frac{V_{1}}{V_{2}}.\]Nápověda
a) Rozmyslete si, zda není možné spočítat práci plynu, kterou plyn vykoná během jednoho cyklu cyklického děje, bez použití vzorců pro práci.
b) Zkuste upravit Poissonův zákon tak, aby v něm vystupovala termodynamická teplota.
Rozbor
Abychom mohli vyjádřit účinnost Ottova cyklu, musíme znát práci vykonanou plynem během jednoho oběhu a teplo, které plyn během jednoho cyklu přijal. Účinnost je pak podíl práce a dodaného tepla.
Pro kruhové děje platí, že změna celkové vnitřní energie plynu během jednoho oběhu je nulová. To nastává díky tomu, že plyn má na začátku i na konci každého cyklu stejný stav a že vnitřní energie je stavová veličina (její změna závisí pouze na počátečním a koncovém stavu, nikoli na průběhu děje). Podle prvního termodynamického zákona tedy platí, že práci plynu lze vyjádřit jako rozdíl tepla dodaného a odevzdaného.
Protože při adiabatických dějích se teplo nepředává, tak plyn přijme teplo pouze při izochorickém zahřátí a odevzdá teplo při izochorickém ochlazení.
Dodané a odevzdané teplo spočítáme pomocí molární tepelné kapacity při konstantním objemu. Po určení těchto tepel již můžeme vyjádřit účinnost Ottova cyklu. Pro vyjádření účinnosti pomocí kompresního poměru a Poissonovy konstanty využijeme Poissonův zákon upravený pomocí stavové rovnice pro ideální plyn tak, že se v něm vyskytuje termodynamická teplota místo tlaku.
Řešení
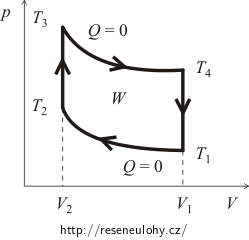
Na počátku je jako obvykle třeba získat představu o tom, jak uvedený cyklus vypadá v p–V diagramu. K tomu nám poslouží znalosti o průběhu izochor a adiabat. Přibližný nákres Ottova cyklu je patrný z následujícího obrázku.
Účinnost η cyklu je definována jako
\[\eta = \frac{W}{Q_{dod}},\]kde W je práce vykonaná během jednoho cyklu plynem zmenšená o práci vykonanou vnějšími silami (v diagramu je znázorněna jako obsah plochy ohraničené cyklem!) a Qdod teplo dodané během oběhu do systému.
Práci W bychom mohli spočítat díky znalosti vztahů mezi tlakem a objemem během adiabatické expanze a komprese (při izochorických dějích je práce samozřejmě nulová). V této úloze však bude výhodnější vyjít z toho, že celková změna vnitřní energie za celý cyklus musí být rovna nule (dostáváme se zase do stejného stavu jako na začátku, tudíž je stejná teplota, a tedy i vnitřní energie!). Z 1. termodynamického zákona pak vyplývá, že práci plynu lze vyjádřit jako rozdíl dodaného tepla Qdod a odevzdaného tepla Qod. Vzorec pro účinnost cyklu tak můžeme přepsat do tvaru:
\[\eta = \frac{W}{Q_{dod}} = \frac{Q_{dod}-Q_{od}}{Q_{dod}}.\]Nejprve spočteme dodané teplo Qdod. Je jasné, že při adiabatických dějích tepelná výměna vůbec neprobíhá, a při izochorickém ochlazení je teplo ze systému naopak odebíráno. Díky tomu bude teplo dodáváno pouze během izochorického zahřátí z teploty T2 na T3. Velikost tohoto tepla lze pomocí látkového množství plynu n a jeho molární tepelné kapacity CV vyjádřit následovně:
\[Q_{dod} = nC_{V}\left( T_{3}-T_{2} \right) \]Velmi podobným způsobem vyjádříme i velikost odevzdaného tepla Qod. Již víme, že k odevzdávání dochází pouze při izochorickém ochlazení z teploty T4 zpět na počáteční teplotu T1. Díky tomu bude platit:
\[Q_{od} = nC_{V}\left( T_{4}-T_{1} \right) \]Dosazením do vzorce pro účinnost cyklu pak okamžitě dostáváme:
\[\eta = \frac{Q_{dod}-Q_{od}}{Q_{dod}} = \frac{nC_{V}\left( T_{3}-T_{2} \right) - nC_{V}\left( T_{4}-T_{1} \right)}{nC_{V}\left( T_{3}-T_{2} \right)} = \] \[=1 - \frac{T_{4} - T_{1}}{T_{3} - T_{2}}\]Nyní bude potřeba nějakým způsobem vyjádřit rozdíly teplot pomocí zadaného kompresního poměru
\[r=\frac{V_{1}}{V_{2}}\]a Poissonovy konstanty κ.
K tomu se nám bude hodit Poissonův zákon pVκ = C = konst., kde jsme konstantu označili C a který upravíme pomocí stavové rovnice pro ideální plyn
\[\frac{pV}{T} = K \quad\Rightarrow\quad p = \frac{T}{V} K\]Vyjádřený tlak dosadíme do Poissonova zákona, rovnici upravíme a konstanty (C a K) dáme na jednu stranu:
\[pV^{\kappa} = C \quad\Rightarrow\quad\frac{T}{V}V^{\kappa} K = C \quad\Rightarrow \quad TV^{\kappa - 1} = \frac{C}{K} = \mathrm{konst.}\]Takto upravený Poissonův zákon postupně uplatníme pro oba adiabatické procesy. Pro adiabatickou expanzi dostáváme vztah
\[T_{4}V_{1}^{\kappa - 1} = T_{3}V_{2}^{\kappa - 1},\]pro adiabatickou kompresi poté
\[T_{1}V_{1}^{\kappa - 1} = T_{2}V_{2}^{\kappa - 1}.\]Nyní odečteme druhou rovnici od první a vytkneme V1κ − 1 na straně jedné a V2κ − 1 na straně druhé a získáme:
\[\left( T_{4}-T_{1}\right) V_{1}^{\kappa -1} = \left( T_{3}-T_{2}\right) V_{2}^{\kappa -1} \Rightarrow \frac{T_{4}-T_{1}}{T_{3}-T_{2}} = \left( \frac{V_{2}}{V_{1}}\right) ^{\kappa - 1} \Rightarrow\] \[\Rightarrow \frac{T_{4}-T_{1}}{T_{3}-T_{2}} = \left( \frac{1}{r}\right) ^{\kappa - 1}\]Vidíme, že se nám rozdíly teplot skutečně podařilo vyjádřit pomocí zadaných veličin. Dosazením do vzorce pro účinnost pak dostáváme konečný vzorec:
\[\eta = 1-\frac{T_{4}-T_{1}}{T_{3}-T_{2}} = 1-\left( \frac{1}{r}\right) ^{\kappa - 1}\] \[\eta = 1-r^{1-\kappa}\]Odpověď
Účinnost Ottova cyklu je tedy dána vztahem
\[\eta = 1-r^{1-\kappa}.\]