Tlak v sifonové bombičce
Úloha číslo: 467
Sifonová bombička má vnitřní objem 10 cm3 a obsahuje 7 g oxidu uhličitého (CO2). Vypočtěte tlak uvnitř bombičky při pokojové teplotě 20 °C podle modelu ideálního plynu. Diskutujte reálnost získaného výsledku.
Nápověda
Ve stavové rovnici znáte hodnotu všech veličin kromě hledaného tlaku a látkového množství. Zamyslete se, jak by se dalo vyjádřit látkové množství, když víme, že se jedná o oxid uhličitý a známe hmotnost plynu.
Zápis
V = 10 cm3 = 10·10−6 m3 = 10−5 m3 objem sifonové bombičky m = 7 g = 7·10−3 g hmotnost oxidu uhličitého CO2 t = 20 °C => T = 293,15 K teplota p = ? tlak uvnitř bombičky Z tabulek:
R = 8,31 JK−1mol−1 molární plynová konstanta Ar(C) = 12 relativní atom. hmotnost uhlíku C Ar(O) = 16 relativní atom. hmotnost kyslíku O Řešení
Do stavové rovnice ideálního plynu
\[pV=nRT\]dosadíme za látkové množství n ze vztahu
\[n=\frac{m}{M_{\mathrm{m}}}\,,\]kde Mm je molární hmotnost oxidu uhličitého. Jednoduchou úpravou vyjádříme tlak p:
\[pV=\frac{m}{M_{\mathrm{m}}}RT\qquad\Rightarrow\qquad p=\frac{mRT}{V\,M_{\mathrm{m}}}.\]Číselné dosazení:
Nejprve si vyjádříme relativní molekulovou hmotnost Mr oxidu uhličitého CO2:
Mr(CO2) = 12 + 16 + 16 = 44
a pomocí ní jeho molární hmotnost Mm
Mm(CO2) = 44 g mol−1 = 44·10−3 kg mol−1.
Potom dosadíme zadané hodnoty do odvozeného vztahu
\[p=\frac{mRT}{V\,M_{\mathrm{m}}}=\frac{7\cdot{10^{-3}}\cdot{8{,}31}\cdot{293{,}15}}{10^{-5}\cdot{44}\cdot{10^{-3}}}\,\mathrm{Pa}\] \[p\dot=38{,}8\cdot{10^{6}}\,\mathrm{Pa}=38{,}8\,\mathrm{MPa}\]Reálnost získaného výsledku
V předchozím oddíle jsem spočítali, že podle modelu ideálního plynu by tlak v bombičce byl 38,8 MPa, což není možné. Pro takto vysoké tlaky by bombička musela mít výrazně silnější stěny, aby se neroztrhla.
Zkusme si vyhledat fázový diagram oxidu uhličitého.
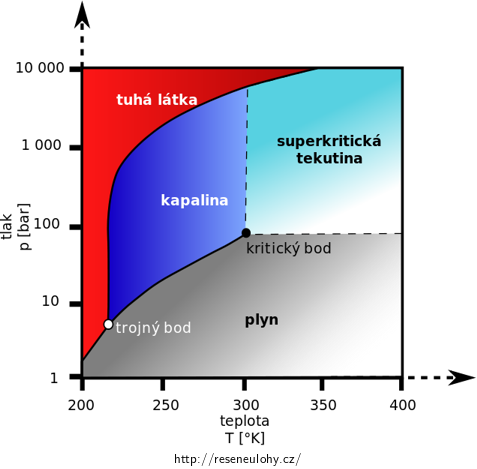
Pozn.: převzato z http://cs.wikipedia.org/wiki/Oxid_uhličitý.
Převedeme si stavové veličiny do jednotek uvedených v grafu. Teplotě 20 °C odpovídá termodynamický teplota 293 K a pro tlak platí 38,8 MPa = 388 bar. Pohledem do diagramu vidíme, že za těchto podmínek je oxid uhličitý kapalný zcela určitě. Při napouštění plynu do bombičky dojte tedy k jeho zkapalnění a díky tomu bude tlak v bombičce podstatně menší než nám vyšlo z modelu ideálního plynu.
Odpověď
Pokud bychom předpokládali, že oxid uhličitý se chová jako ideální plyn, potom by tlak uvnitř sifonové bombičky byl přibližně 38,8 MPa. Takto vysoký tlak by bombička nevydržela. Ve skutečnosti je plyn v bombičce zkapalněn.
Pro zajímavost
Sifonová bombička se používá do sifonové láhve na domácí výrobu sodovky. Výrobci těchto bombiček uvádějí, že jejich obsah je 8 g CO2. Existují také podobné láhve na výrobu šlehačky, do kterých se však dávají bombičky plněné oxidem dusným N2O, též nazývaným rajský plyn.




