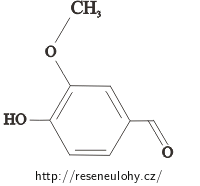
Vanilín
Úloha číslo: 339
Jednou z chemikálií, na kterou je lidský nos velmi citlivý, je vanilín. Lze jej zaznamenat už při koncentraci 2·10−11 g v jednom litru vzduchu.
Kolik molekul vanilínu musíme mít v nosní dírce, abychom ucítili jeho přítomnost? Objem nosní dírky odhadněte.
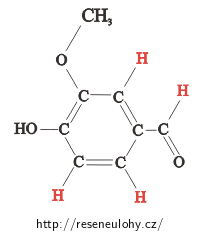
Pozn: vanilín = 4-hydroxy-3-methoxybenzaldehyd (viz obrázek).Nápověda – vzorec vanilínu
Souhrnný vzorec vanilínu určíme pomocí strukturního vzorce. Do zjednodušeného vzorce u zadání dokreslete nejprve uhlíky do vrcholů „šestiúhelníkového cyklu“ a do „zlomu vazby“ vpravo na obrázku. Potom doplňte do obrázku vodíkové atomy tak, aby všechny uhlíkové atomy měly čtyři vazby.
Řešení
Pomocí souhrnného vzorce vanilínu C8H8O3 určíme relativní molekulovou hmotnost vanilínu:
\[A_\mathrm{r}\,=\,8A_r\mathrm{(C)}\, + \,8A_\mathrm{r}\mathrm{(H)}\, +\, 3A_\mathrm{r}\mathrm{(O)}, \] \[A_\mathrm{r}\,=\, 8\cdot{12} \,+\, 8\cdot\,1 \,+\, 3\cdot{16} \,=\, 152.\]Odtud plyne, že molární hmotnost vanilínu je:
\[M_\mathrm{m}\,=\,152\,\mathrm{\frac{g}{mol}} \,=\,0{,}152\,\mathrm{\frac{kg}{mol}}.\]Pomocí molární hmotnosti Mm určíme, kolik molekul musí být v jednom litru vzduchu, abychom vanilín ucítili, tj. kolik molekul odpovídá 2·10-11 g vanilínu:
\[N_1\,=\,\frac{m}{M_\mathrm{m}}\,N_\mathrm{A}, \] \[N_1\,=\,\frac{2\,\cdot\,10^{-11}\mathrm{g}}{152\,\mathrm{g\,mol^{-1}}} \,\cdot\, 6{,}022 \,\cdot\,10^{23} \,\dot=\, 7{,}9\,\cdot\,10^{10}.\]Koncentrace 2·10-11 g l-1 tedy odpovídá hustotě částic \(N_\mathrm{V}\,=\,8\cdot\,10^{10} \,\mathrm{l^{-1}}.\)
Objem jedné nosní dírky můžeme odhadnou na V = 2 ml = 2·10-3 l.
V takové nosní dírce tedy musí být alespoň:
\[N\,=\, N_\mathrm{V}\,V \,=\, 8\,\cdot\,10^{10}\, \mathrm{l}^{-1} \,\cdot\,2 \,\cdot\, 10^{-3}\,\mathrm{l}, \] \[N\,=\,1{,}6 \, \cdot\, 10^8 \dot= \,2\,\cdot\,10^8 \,\mathrm{molekul}\,.\]Odpověď
Pokud chceme vanilín ucítit, musí být v jedné nosní dírce o objemu 2 ml přibližně 200 miliónu molekul.