Cyklický děj ideálního plynu
Úloha číslo: 416
Ideální plyn přejde ze stavu p1, V1, T1 izotermickou kompresí do stavu p2, V2, T2, a z něho pak izobarickou expanzí do p3, V3, T3, z něhož se následně izochorickým dějem vrací do původního stavu. Načrtněte cyklus. Určete, při kterém z uvedených dějů soustava koná práci, a kdy nastane tepelná výměna s okolím.
Nápověda – jak nakreslit pV-diagram
Pro každý děj si nejprve rozmyslete, která ze stavových veličin tlak p, objem V a teplota T je konstantní a jaký je vztah mezi ostatními dvěma. Potom rozhodněte, jak daný děj zakreslit do pV-diagramu.
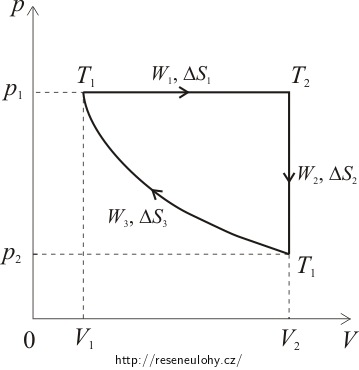
pV-diagram
Ze stavu 1 do stavu 2 přechází plyn izotermickou kompresí, při níž je konstantní teplota a tlak je nepřímo úměrný objemu (plyne z Boyle-Mariottova zákona). Tento děj bude v diagramu znázorněn částí hyperboly. Šipka ukazující směr průběhu děje bude ukazovat zprava doleva, protože objem se při kompresi zmenšuje.
Ze stavu 2 do stavu 3 přechází plyn izobarickou expanzí, při níž je konstantní tlak. V diagramu bude tento děj znázorněn vodorovnou úsečkou. Protože při expanzi roste objem, bude stav 3 vpravo od stavu 2.
Ze stavu 3 do původního stavu se plyn dostává izochorickým dějem. Při něm je konstantní objem, a tudíž bude znázorněn svislou úsečkou.
Nápověda – kdy se koná práce a předává teplo
Jestliže objem plynu
- roste, potom plyn koná práci (rozpíná se),
- je konstantní, potom nekoná práci ani plyn, ani okolí,
- klesá, potom koná práci okolí (plyn je stlačován), tj. uvažujeme „práci vykonanou plynem jako zápornou“.
Vnitřní energie ideálního plynu je úměrná teplotě, tj. pokud se teplota mění, tak se stejným způsobem mění i vnitřní energie.
Dodané či odevzdané teplo potom již lze určit pomocí zákona zachování energie, kterému se v tomto kontextu obvykle říká první termodynamický zákon.
Řešení
Děj 12 – izotermická komprese
Při izotermické kompresi klesá objem plynu, práci tedy koná okolí. Protože je teplota konstantní, nemění se ani vnitřní energie. Plyn musí odevzdat teplo, jehož velikost je číselně rovna práci vykonané okolím.
Děj 23 – izobarická expanze
Při expanzi objem plynu roste, práci tedy koná plyn. Teplota je při izobarickém ději přímo úměrná objemu (plyne z Gay-Lussacova zákona), proto zde spolu s ním roste. Dochází tedy i ke zvýšení vnitřní energie plynu. To v souladu s 1. termodynamickým zákonem znamená, že plyn teplo přijímá.
Děj 31 – izochorický děj
Při izochorickém ději se nemění objem, práci tedy nekoná ani plyn, ani okolí. Zároveň dochází ke snižování teploty, protože ta je při izochorickém ději přímo úměrná tlaku (plyne z Charlesova zákona). Vnitřní energie tedy klesá a plyn musí teplo odevzdávat.
Odpověď
pV-diagram

Shrnutí
děj vnitřní energie U práce W teplo Q izotermická komprese nemění se koná okolí odevzdané izobarická expanze roste koná plyn přijaté izochorický děj klesá nekoná se odevzdané





