Diagramy cyklického děje
Úloha číslo: 341
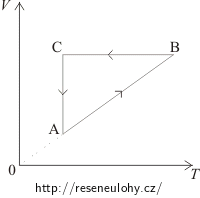
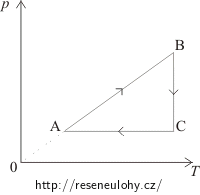
Ideální plyn stálé hmotnosti vykonává kruhové děje ABCA (dle obrázků). Překreslete tyto děje do pV–diagramu.
|
|
| a) | b) |
Určete dále, ve kterých fázích plyn přijímá teplo od okolí a kdy je odevzdává, kdy koná práci plyn a kdy okolí.
Nápověda – jak překreslit diagramy
Pro každou část diagramu si nejprve rozmyslete, která ze stavových veličin popisujících plyn (p, V, T) je konstantní a které jsou si sobě úměrné. Potom rozhodněte, jak daný děj zakreslit do pV–diagramu.
Nápověda – kdy se koná práce a předává teplo
Jestliže objem plynu
- roste, potom plyn koná práci (rozpíná se),
- je konstantní, potom nekoná práci ani plyn, ani okolí,
- klesá, potom koná práci okolí (plyn je stlačován), tj. uvažujeme „práci plynu zápornou“.
Vnitřní energie ideálního plynu je úměrná teplotě, tj. pokud se teplota mění, tak se stejným způsobem mění i vnitřní energie.
Dodané či odevzdané teplo potom již lze určit pomocí zákona zachování energie, kterému se v tomto případě obvykle říká první termodynamický zákon.
Řešení – překreslení diagramu a)
Z VT–diagramu vidíme:
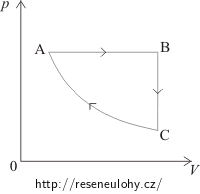
V části AB je objem plynu úměrný teplotě. To znamená, že v této části je tlak konstantní, jedná se o izobarický děj. Ten je v pV–diagramu znázorněn vodorovnou úsečkou. Protože od A k B roste objem, bude i v pV–diagramu stav A vlevo a stav B vpravo.
V části BC je konstantní objem, jedná se izochorický děj v pV–diagramu znázorněný svislou úsečkou. Protože od B k C klesá teplota, bude klesat i tlak a stav C bude pod stavem B.
Při přechodu od stavu C ke stavu A je konstantní teplota = izotermický děj, v pV–diagramu znázorněný částí hyperboly.
Řešení – energetická bilance a)
část cyklu energetická bilanceAB izobarický děj - zvětšuje se objem ⇒ plyn koná práci
- roste teplota ⇒ roste vnitřní energie ⇒ musíme dodávat teplo
- dodané teplo = přírůstek vnitřní energie + práce vykonaná plynem
BC izochorický děj - nemění se objem ⇒ práce není konána ani plynem ani okolím
- klesá tlak ⇒ klesá i teplota ⇒ klesá vnitřní energie ⇒ odebíráme teplo
- odevzdané teplo = úbytek vnitřní energie
CA izotermický děj - konstantní teplota ⇒ nemění se vnitřní energie
- klesá objem plynu ⇒ plyn je stlačován ⇒ okolí koná práci
- aby zůstala konstantní teplota při stlačování, musíme plyn chladit ⇒ plyn odevzdává teplo
- práce vykonaná okolím = teplo odevzdané plynem
Řešení – překreslení diagramu b)
Z pT–diagramu vidíme:
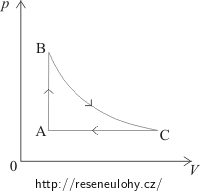
V části AB je tlak úměrný teplotě, to znamená, že objem zůstává konstantní a jedná se izochorický děj. V pV–diagramu půjde o svislou úsečku. Tlak od A k B roste, proto i v pV–diagramu bude stav A pod stavem B.
Mezi stavy B a C je konstantní teplota, jedná se o izotermický děj v pV–diagramu zakreslený pomocí hyperboly tak, aby objem rostl.
Při přechodu od C k A je konstantní tlak = izobarický děj. Do pV–diagramu ho zakreslíme jako vodorovnou úsečku směrem doleva, protože objem klesá.
Řešení – energetická bilance b)
část cyklu energetická bilanceAB izochorický děj - nemění se objem ⇒ práce není konána ani plynem ani okolím
- roste tlak ⇒ roste i teplota ⇒ roste vnitřní energie ⇒ dodáváme teplo
- dodané teplo = přírůstek vnitřní energie
BC izotermický děj - konstantní teplota ⇒ nemění se vnitřní energie
- roste objem plynu ⇒ plyn se rozpíná ⇒ plyn koná práci
- aby zůstala konstantní teplota při rozpínání, musíme plyn ohřívat ⇒ plyn přijímá teplo
- práce vykonaná plynem = teplo dodané plynu
CA izobarický děj - zmenšuje se objem plynu ⇒ okolí koná práci (stlačuje plyn)
- klesá teplota ⇒ klesá vnitřní energie ⇒ musíme odebírat teplo
- odebrané teplo = úbytek vnitřní energie + práce vykonaná okolím





