Vibrace molekuly HCl
Úloha číslo: 620
a) Odhadněte energetický rozdíl mezi prvními dvěma vibračními stavy (základním a prvním excitovaným) molekuly HCl, která se chová jako lineární harmonický oscilátor (LHO), pro který je síla pružnosti úměrná výchylce přes konstantu C = 470 N·m−1.
b) Může být molekula HCl excitována ze základního do prvního excitovaného stavu pouze vlivem pokojové teploty v místnosti?
Teoretický úvod
Stejně jako v makroskopických rozměrech (astronomie), také v měřítku atomů a molekul se hodí řešit dvoučásticové problémy převedením na problém pohybu jedné efektivní částice kolem společného těžiště původních dvou částic. Konkrétně vibrace dvouatomové molekuly mohou být popsány jako lineárně harmonické kmity jedné efektivní částice.
Nechť jsou rovnovážné polohy atomu o hmotnosti m1 a atomu o hmotnosti m2 ve vzdálenosti R.
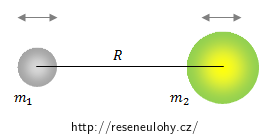
Předpokládejme, že oba atomy kmitají kolem svých rovnovážných poloh se stejnou kruhovou frekvencí ω. Celá molekula se chová jako LHO, síla pružnosti závisí na výchylce přímo úměrně s konstantu úměrnosti charakteristickou pro daný prvek:
\[F_p = -C{\Delta}R.\]Situaci lze převést na kmitání jedné efektivní částice o hmotnosti
\[m_{\mbox{ef}}=\frac{m_1 \,\cdot\,m_2}{m_1 \,+\, m_2}\]kolem těžiště, které leží někde na spojnici středů či přesněji rovnovážných poloh obou atomů.
Nápověda 1
Molekula HCl se chová jako LHO, síla pružnosti závisí na výchylce přímo úměrně:
\[F_p=-Cx ,\ C=470\, \mbox{N · m}^{-1} .\]Převedeme-li situaci na kmitání jedné efektivní částice o hmotnosti
\[m_{\mbox{ef}}=\frac{m(\mbox{H})\,\cdot\, m(\mbox{Cl})}{m(\mbox{H}) \,+\, m(\mbox{Cl})}\]kolem těžiště molekuly, čemu je rovna její energie?
Podaří se vám najít vztah pro kruhovou frekvenci kmitů ω?
Nápověda 2
Jaká je atomová hmotnost 1H a 35Cl?Nápověda 3
Jak vypadá energetické spektrum LHO (z pohledu kvantové mechaniky)?Řešení a)
V teoretickém úvodu a v první nápovědě zaznělo, že celý problém lze řešit jako kmitání jedné efektivní částice o hmotnosti
\[m_{\mbox{ef}}=\frac{m(\mbox{H})\,\cdot\, m(\mbox{Cl})}{m(\mbox{H}) \,+\, m(\mbox{Cl})}\]kolem jisté rovnovážné polohy. Dosadíme-li atomové hmotnosti vodíku a chlóru, dostáváme
\[m_{\mbox{ef}}=\frac{1m_{\mbox{u}}\,\cdot\, 35m_{\mbox{u}}}{1m_{\mbox{u}} + 35m_{\mbox{u}}}=\frac{35}{36}\,m_{\mbox{u}} ,\]kde mu je tzv. atomová hmotnostní jednotka a platí mu = 1,66·10−27 kg.
Ve třetí nápovědě jsme připomněli, že diskrétní hladiny energie LHO jsou tvaru
\[\hspace{40px}E_n=\left( n+\frac{1}{2}\right)\,\hbar\omega , \] n = 0, 1, 2, ... .
Přechodu mezi základním a prvním excitovaným stavem tedy odpovídá
\[\Delta E=\hbar\omega .\]V řešení první nápovědy jsme ukázali, že
\[\omega=\sqrt{\frac{C}{m_{ef}}} ,\]je tedy
\[\Delta E=\hbar\sqrt{\frac{C}{m_{ef}}}\] \[\Delta E=1{,}055{\cdot} 10^{-34}\,\mathrm{J\cdot s} \ \sqrt{470\,\mathrm{N\cdot m}^{-1}\,\frac{36}{35\,\cdot\,1{,}66{\cdot} 10^{-27}\ \mbox{kg}}}\,\dot{=}\,\ 5{,}7{\cdot} 10^{-20}\,\mbox{J}\,\dot{=}\,\ 0{,}356\,\mbox{eV}.\]Nápověda 4
Existuje nějaký vztah vyjadřující souvislost mezi možným přírůstkem energie dané částice a teplotou okolního prostředí?Řešení b)
Jak už víme z části a), energetický rozdíl mezi základním a prvním excitovaným stavem je přibližně
\[\Delta E\,\dot{=}\,5{,}7\,\cdot\,10^{-20}\ \mbox{J} .\]Teplota potřebná k dodání takové energie by byla
\[\hspace{40px}T=\frac{\Delta E}{k},\] (více k tomuto vztahu v přecházející nápovědě)
\[T=\frac{5{,}7{\cdot} 10^{-20}\,\mbox{J}}{1{,}38{\cdot} 10^{-23}\,\mbox{J·K}^{-1}}\,\dot{=}\, 4100\,\mbox{K} .\]Pokojovou teplotou nerozumíme více než asi 300 K, což tedy evidentně k excitaci molekuly HCl nestačí.
Odkaz
Více informací na toto téma si můžete přečíst na anglické wikipedii na adrese: http://en.wikipedia.org/wiki/Heat_capacity (v odstavci The effect of quantum energy levels in storing energy in degrees of freedom).
Aplet
Shrňme si nejprve zadané hodnoty a výsledky získané v průběhu řešení této úlohy. Máme částici o hmotnosti m = 35/36 mu ≈ 906 MeV/c2, která se chová jako LHO s konstantou pružnosti C = 470 N/m = 470 J/m2 ≈ 2934 eV/nm2.
Pro kruhovou frekvenci \(\omega\) platí \[\omega=\sqrt{\frac{C}{m}}\] a hladiny diskrétního energetického spektra nabývají hodnot \[E_n=\left(n\,+\,\frac{1}{2}\right)\,\hbar\omega ,\] kde n = 0, 1, 2, ... Rozdíl energií základního a prvního excitovaného stavu je \[\Delta E=\hbar\omega=\hbar\,\sqrt{\frac{C}{m}}.\]
Úlohu jsme již vyřešili početně a nyní můžeme výsledek porovnat s hodnotou, kterou pro danou situaci vypočítá aplet dostupný na adrese http://www.falstad.com/qm1d/.
Vpravo nahoře vyberte možnost Setup: Harmonic Oscillator. Nahoře v záložce View (zobrazit) zaškrtněte položky Energy (energie), Position (poloha), State Phasors (fázory stacionárních stavů), Values/Dimensions (hodnoty/rozměry) a Expectation Values (střední hodnoty). Po pravé straně je možno regulovat hodnoty Particle Mass (hmotnost částice) a Spring Constant (konstanta pružnosti). Záhy zjistíme, že rozsah obou těchto parametrů nepokrývá naše vstupní hodnoty. Kdybychom však v apletu nastavili hmotnost tisíckrát menší a konstantu pružnosti desetkrát menší, než jak vystupují v naší úloze, vyjde úhlová frekvence i energie desetkrát větší, než by odpovídalo našim hodnotám. (Rozmyslete si.) Převod pak již bude snadný.
Hmotnost částice a šířku jámy je možno nastavit pouze na určité diskrétní hodnoty. Při defaultním nastavení Resolution (rozlišení) je z dostupných hodnot nejblíže hmotnost 894,25 keV/c2 a konstanta pružnosti 290,58 eV/nm2 (značená písmenem k, které my v této úloze nepoužíváme, aby nedocházelo k záměně s Boltzmannovou konstantou). Dvojklikem na první/druhé kolečko ve spodní části okna nebo kliknutím na první/druhou možnou hladinu energie v horní části okna zvolte požadovaný stacionární stav. Aplet pod grafy ukáže střední hodnotu energie, která se v případě stacionárního stavu rovná přímo jediné možné hodnotě energie dané částice.
Odpověď
a) Energetický rozdíl mezi základním stavem a prvním excitovaným stavem molekuly HCl je roven přibližně 0,356 eV.
b) Ne, molekula HCl nemůže být excitována ze základního do prvního excitovaného stavu pouze vlivem pokojové teploty v místnosti.



